- HOME
- 研究
- 消化器がん幹細胞・薬物治療研究グループ
消化器がん幹細胞・薬物治療研究グループ

研究概要
我々は、消化器がんの増殖や再発、転移、薬物療法抵抗性などに関連するがん幹細胞研究を通じて、新たな診断・治療バイオマーカーの同定や、新規薬物療法の開発を目標としています。
研究1
肝幹細胞マーカーを用いた肝癌亜分類
肝癌は世界の悪性腫瘍による死因の第2位を占め、本邦でも未だ代表的な難治癌であり、新たな診断治療法の開発が強く求められています。我々は、肝癌の悪性度を決定する要因として、癌の発生、維持、薬剤抵抗性、遠隔転移に必須の役割を果たしていると考えられる肝癌幹細胞を同定し1)2)3)、その多様性が肝癌の悪性形質に深く関わることを報告してきました4)。さらに近年、幹細胞/肝細胞マーカーの発現解析により、肝癌を大きく2つのサブタイプに分類しました5)。その中で、肝幹細胞マーカーの一つである上皮細胞接着分子(EpCAM)陽性肝癌は、Wnt/βカテニンシグナルが亢進し、脈管浸潤傾向が強く、非常に予後不良であること、さらに、一方のサブタイプであるCD90陽性肝癌は、間葉系幹細胞様で転移性が強いサブタイプである事を明らかにしました。また、我々は、肝細胞癌の腫瘍マーカーとしても知られる肝前駆細胞マーカーαフェトプロテイン(AFP)と、肝癌画像診断に用いられるMRI用ガドキセト酸ナトリウム(Gd-EOB-DTPA)造影剤の取り込み能を用いた肝癌の亜分類を行いました6)。その中で、AFP値が低く、Gd-EOB-DTPAの取り込みが高い癌は、肝臓特異的有機アニオントランスポーターOATP1B1や肝細胞核内因子HNF4αの発現が高い成熟肝細胞様の機能を保持し、その他の癌サブタイプに比べ予後良好である事を明らかにしました。これらの研究結果は、肝癌の悪性度診断や治療法の開発に大きく寄与する事が期待されます。
参考
- Yamashita T, Budhu A, Forgues M, Wang XW. Activation of hepatic stem cell marker EpCAM by Wnt-beta-catenin signaling in hepatocellular carcinoma. Cancer Res. 2007 Nov 15;67(22):10831-9.
- Yamashita T, Forgues M, Wang W, Kim JW, Ye Q, Jia H, Budhu A, Zanetti KA, Chen Y, Qin LX, Tang ZY, Wang XW. EpCAM and alpha-fetoprotein expression defines novel prognostic subtypes of hepatocellular carcinoma. Cancer Res. 2008 Mar 1;68(5):1451-61.
- Yamashita T, Ji J, Budhu A, Forgues M, Yang W, Wang HY, Jia H, Ye Q, Qin LX, Wauthier E, Reid LM, Minato H, Honda M, Kaneko S, Tang ZY, Wang XW. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features. Gastroenterology. 2009;136: 1012–24.
- Yamashita T, Wang XW. Cancer stem cells in the development of liver cancer. J Clin Invest. 2013 May;123(5):1911-8.
- Yamashita T, Honda M, Nakamoto Y, Baba M, Nio K, Hara Y, Zeng SS, Hayashi T, Kondo M, Takatori H, Yamashita T, Mizukoshi E, Ikeda H, Zen Y, Takamura H, Wang XW, Kaneko S. Discrete nature of EpCAM+ and CD90+ cancer stem cells in human hepatocellular carcinoma. Hepatology. 2013 Apr;57(4):1484-97.
- Yamashita T, Kitao A, Matsui O, Hayashi T, Nio K, Kondo M, Ohno N, Miyati T, Okada H, Yamashita T, Mizukoshi E, Honda M, Nakanuma Y, Takamura H, Ohta T, Nakamoto Y, Yamamoto M, Takayama T, Arii S, Wang X, Kaneko S. Gd-EOB-DTPA-enhanced magnetic resonance imaging and alpha-fetoprotein predict prognosis of early-stage hepatocellular carcinoma. Hepatology. 2014 Nov;60(5):1674-85.
研究2
肝癌の幹細胞性や抗癌剤抵抗性に関わる分子の同定と新たな治療法の検討
癌幹細胞は、自己複製能・多分化能・強い造腫瘍性を有するがんの“源”と考えられていますが、その根絶には癌幹細胞が持つ幹細胞維持メカニズムや薬剤抵抗性を打破する治療開発が求められています。
我々は、以前に肝幹細胞マーカーであるEpCAMが肝癌における癌幹細胞マーカーである事を報告しましたが、さらにEpCAM陽性肝癌では、幹細胞性を制御する転写因子である SALL4 が高発現していることを同定しました。SALL4は、ヒストン脱アセチル化酵素(HDAC)とともにクロマチンリモデリング複合体を形成することから、HDAC 阻害剤による効果を検討したところ、HDAC阻害剤により SALL4 の発現低下、EpCAM 陽性幹細胞数の減少が見られる事を見出しました1)。一方、HDAC阻害剤の単独治療では、十分な肝癌増殖抑制効果は得られないため、関連する他の治療ターゲット分子を検索し、更なる治療法の開発を行いました。
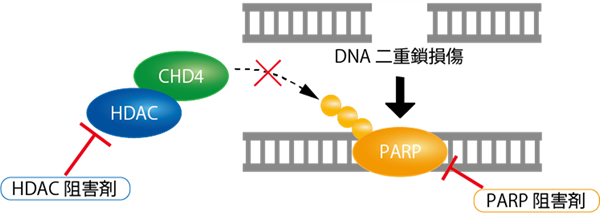
その結果、EpCAM陽性肝癌では、クロマチンリモデリング因子CHD4が高発現し、薬剤抵抗性やがん幹細胞性維持に関与する事を同定しました2)。CHD4は、HDACと複合体を形成し、ポリ(ADP-リボース)ポリメラーゼ(PARP)を介して、DNA損傷部にリクルートする事で、DNA修復に関与する事が報告されています。我々は、CHD4のDNA修復機能を阻害するために、HDAC阻害剤とPARP阻害剤の併用治療効果を検討し、その効果を実証しました(図)。HDAC阻害剤とPARP阻害剤の併用治療は、CHD4の発現やその分子機能を抑制することで、肝細胞癌の薬剤感受性を亢進させると考えられるため、既存の薬物療法との組み合わせで更なる抗腫瘍効果が期待されます。
参考
- Zeng SS, Yamashita T, Kondo M, Nio K, Hayashi T, Hara Y, Nomura Y, Yoshida M, Hayashi T, Oishi N, Ikeda H, Honda M, Kaneko S. The transcription factor SALL4 regulates stemness of EpCAM-positive hepatocellular carcinoma. J Hepatol. 2014 Jan;60(1):127-34.
- Nio K, Yamashita T, Okada H, Kondo M, Hayashi T, Hara Y, Nomura Y, Zeng SS, Yoshida M, Hayashi T, Sunagozaka H, Oishi N, Honda M, Kaneko S. Defeating EpCAM (+) liver cancer stem cells by targeting chromatin remodeling enzyme CHD4 in human hepatocellular carcinoma. J Hepatol. 2015;63:1164–72.
研究3
分子標的薬による肝癌幹細胞抑制効果の検討
我々はこれまで、EpCAMとCD90という2つの幹細胞マーカーにて肝細胞癌を分類してきましたが、同一腫瘍内においてもEpCAM陽性/CD90陽性癌幹細胞は独立して存在し異なる腫瘍形成/遠隔転移能を有する事を報告してきました1)。一方、VEGFR2、B-Raf、c-Kitなどを標的とするマルチキナーゼ阻害剤ソラフェニブは、近年、進行肝細胞癌に対する第一選択薬として使用されてきましたが、ソラフェニブが癌幹細胞に与える影響は不明でした。そのため、ソラフェニブ投与がCD90陽性癌幹細胞に及ぼす影響を検討しました。その結果、ソラフェニブはc-Kit発現を抑制し、さらにはCD90陽性癌幹細胞数を減らしました。また、CD90陽性肝癌から放出される細胞外小胞を抑制することで、CD90陽性細胞とEpCAM陽性細胞との細胞間コミュニケーションを阻害し、これらの結果から遠隔転移を制御する事が明らかとなりました2)。この研究により、ソラフェニブの持つ肝細胞癌における抗腫瘍効果の新たな側面が明らかになりました。
参考
- Yamashita T, Honda M, Nakamoto Y, Baba M, Nio K, Hara Y, Zeng SS, Hayashi T, Kondo M, Takatori H, Yamashita T, Mizukoshi E, Ikeda H, Zen Y, Takamura H, Wang XW, Kaneko S. Discrete nature of EpCAM+ and CD90+ cancer stem cells in human hepatocellular carcinoma. Hepatology. 2013 Apr;57(4):1484-97.
- Yoshida M, Yamashita T, Okada H, Oishi N, Nio K, Hayashi T, Nomura Y, Hayashi T1, Asahina Y1 Ohwada M, Sunagozaka H, Takatori H, Colombo F, Porretti L Honda M, Kaneko S. Sorafenib suppresses extrahepatic metastasis de novo in hepatocellular carcinoma through inhibition of mesenchymal cancer stem cells characterized by the expression of CD90. Sci Rep. 2017 Sep 12;7(1):11292.